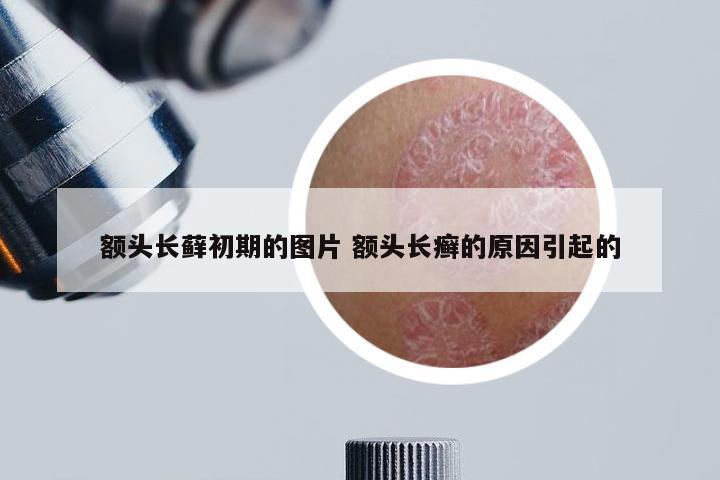
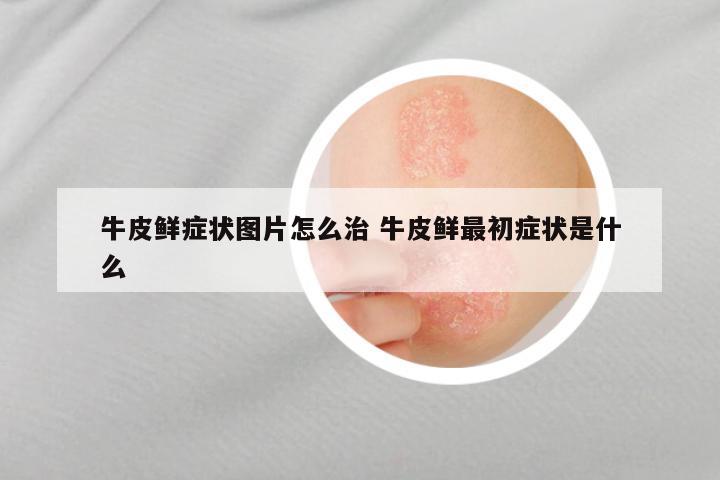
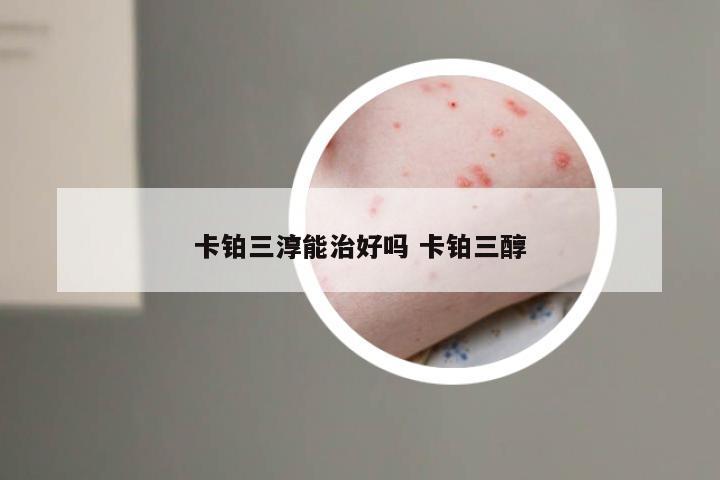
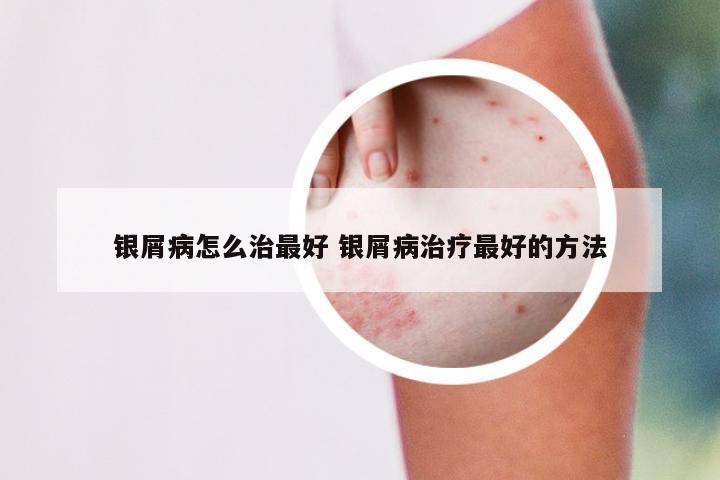
临床实验招募银屑病 2021银屑病生物制剂招募患者
干细胞治疗银屑病,临床试验证实疗效显著!
1、干细胞治疗银屑病,临床试验证实疗效显著。银屑病,又称牛皮癣,是一种慢性复发性炎症性疾病,其治疗一直是一个挑战。近年来,干细胞治疗作为一种新兴的治疗方法,在银屑病的治疗中展现出了显著的疗效。
2、临床试验验证:多项临床试验已经证实了间充质干细胞治疗银屑病的安全性和有效性。例如,在美国国立卫生研究院的临床试验注册库上注册的有关干细胞治疗银屑病的临床研究中,最常应用的干细胞类型为间充质干细胞。
3、干细胞治疗银屑病后,能够显著改善患者的皮肤状况,减轻银屑病的症状,并调节体内的免疫平衡。以下是对干细胞治疗银屑病效果的详细阐述:皮肤外观显著改善:干细胞治疗后,患者的皮肤外观得到明显改善。
4、综上所述,干细胞治疗银屑病通过调节免疫细胞、修复表皮干细胞、调控角质形成细胞以及清除氧化应激产物等多种机制,为银屑病患者提供了一种新的治疗选择。然而,需要注意的是,干细胞治疗目前仍处于研究和临床试验阶段,其疗效和安全性仍需进一步验证。
5、中国学者在ClinicalTrials注册了关于人脐带间充质干细胞干预寻常型银屑病安全性和有效性的临床试验。
全球首批!艾伯维重磅银屑病新药在日本上市
全球首批艾伯维重磅银屑病新药Skyrizi在日本上市,这是针对斑块状银屑病、泛发性脓疱型银屑病、红皮病型牛皮癣和银屑病关节炎成年患者的创新疗法。
艾伯维与勃林格殷格翰联合开发的IL-23抑制剂Skyrizi获得日本厚生劳动省批准上市,用于治疗斑块状银屑病、泛发性脓疱型银屑病、红皮病型牛皮癣和银屑病关节炎成年患者,这是全球首次获批。银屑病是一种炎症性疾病,患者皮肤出现鳞状皮肤增生,伴有严重瘙痒和刺痛。
在日本银屑病新药获批!3个月注射一次可改善皮肤状况 。跨国生物制药公司 艾伯维 宣布,日本厚生劳动省(MHLW)已批准白介素-23(IL-23)抑制剂SKYRIZI (risankizumab)用于治疗对常规治疗 缓解不足的斑块性银屑病、全身脓疱性银屑病、红皮病性银屑病和银屑病性关节炎成年患者 。
乌帕替尼首次于2019年8月获FDA批准上市,用于治疗中重度类风湿性关节炎,成为全球首款获批上市的JAK1抑制剂。此后,乌帕替尼的适应症不断扩展,包括治疗中重度特应性皮炎、活动性银屑病关节炎、中重度活动性溃疡性结肠炎和中度至重度活动性克罗恩病等。
fedratinib(Inrebic):2019年获美国FDA批准用于治疗骨髓纤维化。迪高替尼(delgocitinib):2020年获日本PMDA批准用于局部治疗特应性皮炎,是全球首款JAK局部外用药物。
【新药进展速递】恒瑞医药夫那奇珠单抗再拓3项儿童银屑病临床
恒瑞医药夫那奇珠单抗再拓3项儿童银屑病临床 8月5日,恒瑞医药发布的新闻消息称,其自主研发的夫那奇珠单抗注射液已获得中国国家药监局药品审评中心(CDE)的临床试验默示许可,旨在开发用于治疗年龄在6至18岁之间、适合接受系统治疗或光疗的中重度斑块状银屑病儿童和青少年患者。
恒瑞医药的夫那奇珠单抗是国内首个白介素17A抑制剂,主要用于治疗中重度斑块型银屑病。该药物打破了进口药物在该领域的长期垄断地位,为患者提供了新的治疗选择。
夫那奇珠单抗是靶向人IL-17A的重组人源化单克隆抗体,拟用于治疗与IL-17通路相关的自身免疫疾病。
夫那奇珠单抗注射便捷性高,密集期每年仅需注射3次,全年注射共14次,这为患者提供了更为便利的治疗方案。相比于传统治疗方法,减少了患者的注射频次,极大提高了患者的治疗依从性。简化的给药方式使得患者能够更轻松地管理疾病,进一步提升了治疗的顺利进行和长期效果。
干细胞治疗银屑病
干细胞治疗银屑病的机理主要基于其免疫调节和再生能力。间充质干细胞(MSCs)不仅具有再生能力,还能调节免疫反应,这对于治疗自身免疫性疾病如银屑病具有重要意义。动物研究表明,间充质干细胞能够减轻银屑病小鼠的疾病严重程度、炎性浸润和细胞因子产生。
干细胞治疗银屑病的作用主要体现在以下几个方面:有效缓解银屑病症状:干细胞具有自我更新和分化为多种细胞类型的能力,这使得它们在治疗银屑病时能够发挥重要作用。通过调节免疫系统的功能,干细胞能够减轻银屑病患者的炎症反应,从而有效缓解皮肤红斑、鳞屑等症状。
干细胞治疗银屑病后,能够显著改善患者的皮肤状况,减轻银屑病的症状,并调节体内的免疫平衡。以下是对干细胞治疗银屑病效果的详细阐述:皮肤外观显著改善:干细胞治疗后,患者的皮肤外观得到明显改善。
相比之下,干细胞因子治疗银屑病具有以下优势:从发病根本环节干预:干细胞因子治疗可以从发病的根本环节去干预疾病,克服传统细胞治疗的局限性(如宿主移植细胞的存活率低)。治疗效果显著:个案研究显示,干细胞因子治疗可以显著改善银屑病患者的症状,甚至实现完全清除。
目前的干细胞技术还不行。再等等吧,会有那木一天的。
干细胞治疗银屑病,确实有望在未来发挥不可替代的作用。银屑病,又称“牛皮癣”,是一种免疫介导的慢性炎症性疾病,主要影响皮肤和关节,严重时还可能损伤多种组织器官,引发并发症。患者的生活质量因此大大降低,甚至生命预期也可能受到影响。
重组胶原蛋白产品在泰国临床试验对入组人群有什么要求?
根据重组胶原蛋白产品的特性和预期用途,临床试验会设定特定的年龄范围。例如,若产品主要针对青少年皮肤保养,则入组人群的年龄可能限制在12至18岁之间;若产品旨在改善老年人皮肤弹性,则可能选择60岁以上的受试者。 健康状况 受试者需具备良好的总体健康状况,无严重的慢性疾病或并发症,如心脏病、糖尿病、肝肾功能不全等。
提交格式:按照泰国相关监管机构的要求提交报告,包括纸质版和电子版。提交时间:在规定的期限内提交报告,以确保产品的注册和上市进程不受影响。总之,重组胶原蛋白产品在泰国的临床试验报告应严格按照相关规定和伦理准则进行撰写,确保报告的科学性、准确性和合规性。
需开展临床试验的情形:若产品宣称具有医疗功效(如促进伤口愈合、改善关节功能),或属于第三类医疗器械管理的胶原蛋白制品,必须按《医疗器械临床试验质量管理规范》完成临床试验。
美国FDA批准今年第六款新药,治疗银屑病
1、美国FDA批准的新药ILUMYA用于治疗银屑病。以下是关于该新药的一些关键信息:药物作用机制:ILUMYA是一款创新疗法,通过选择性结合IL23的p19亚基,抑制其与IL23受体作用,从而减少促炎细胞因子和趋化因子的释放,达到治疗银屑病的目的。
2、美国食品药品监督管理局(FDA)近日批准了Sun Pharma公司研发的ILUMYA(tildrakizumab-asmn)用于治疗银屑病。银屑病是一种慢性免疫性疾病,特征为皮肤细胞生长周期加速,形成覆盖白色鳞屑的红色、凸起的皮肤区域,患者通常会经历瘙痒、疼痛,甚至皮肤裂开和出血。
3、Otezla(apremilast,阿普斯特)是生物技术公司安进研发的一款药物,现已在美国获批用于治疗年龄6岁及以上、体重至少44磅且适合接受光疗或全身治疗的儿科中重度斑块状银屑病患者。这是首个也是目前唯一一款针对6-17岁中度至重度斑块状银屑病儿童和青少年的口服药物,为这类患者提供了新的治疗选择。
4、Donanemab (Kisunla):被批准用于治疗早期症状性阿尔茨海默病(AD),分析师预测年销售额约24亿美元。未获批准药物 midomafetamine(MDMA):用于治疗创伤后应激障碍,因临床数据、试验缺乏功能性盲法及安全性问题,以及药物临床开发中不当性行为指控而未获FDA批准。